四川大学华西医院生物治疗国家重点实验室赖颖教授以第一作者和通讯作者于2022年3月23日在Nature杂志上在线发表了最新研究成果Inhibition of Ca2+-triggered secretion by hydrocarbon-stapled peptides。该成果是与美国斯坦福大学、德国乌尔姆大学、美国德州大学安德森癌症中心等共同完成的。该研究揭示了调控粘液素过度分泌的蛋白靶点,开发了一种特异性多肽抑制剂SP9,首次实现抑制粘液素过度分泌,且不影响必要的基线分泌,阻止气道阻塞的症状,在阻塞性肺疾病及囊泡转运相关疾病的药物治疗研究上取得重要进展。
粘液素分泌是含有粘液素囊泡在气道SNARE和钙离子感应蛋白synaptotagmin-2的介导下与呼吸道上皮细胞膜融合而释放粘液素的过程。粘液素逐渐释放到呼吸道中,吸收水分并形成一层薄薄的保护性粘液,构成人体免疫的第一道屏障。而在阻塞性肺疾病中,如哮喘,囊性纤维化,以及慢性阻塞性肺病等,大量的粘液素突然释放,堵塞气道并损害肺功能。因此为了维持正常的肺功能,开发抑制粘液素过度分泌的药物十分重要[1]。目前绝大多数针对缓解呼吸道平滑肌收缩或者减少上皮细胞粘液素合成而研发的药物,其治疗效果并不理想[2]。

赖颖团队基于Axel Brunger研究组解析的神经系统SNARE/synaptogmin-1复合体结构展开研究[3]。1.通过体内synaptotagmin-2基因敲除实验,确定了synaptotagmin-2是介导粘液素过度释放的靶点蛋白。2.针对SNARE/synaptotagmin蛋白复合物的相互作用位点,设计了一种与SNARE竞争结合synaptotagmin的订书肽SP9。3.利用单囊泡内容物融合实验体系,在体外重组模拟了SNARE/synaptotagmin-2介导的粘液素分泌过程,并且证实了SP9能够有效的抑制Ca2+触发的气道SNARE和synaptotagmin-2介导的膜融合过程。4.通过将穿膜肽与SP9连接,将SP9成功递送到上皮细胞后,发现SP9也能显著减少人气道上皮细胞在刺激状态下的粘液素过度分泌,然而对粘液素的基线释放过程影响不大,从而证实了这种订书肽作为治疗剂的潜在应用价值。5.通过雾化PEN-SP9-Cy3对哮喘小鼠模型进行短期处理后,发现SP9能够有效的进入到小鼠气道的上皮分泌细胞中,并且成功抑制了Ca2+触发的粘液素过度分泌并防止了气道阻塞(图1)。
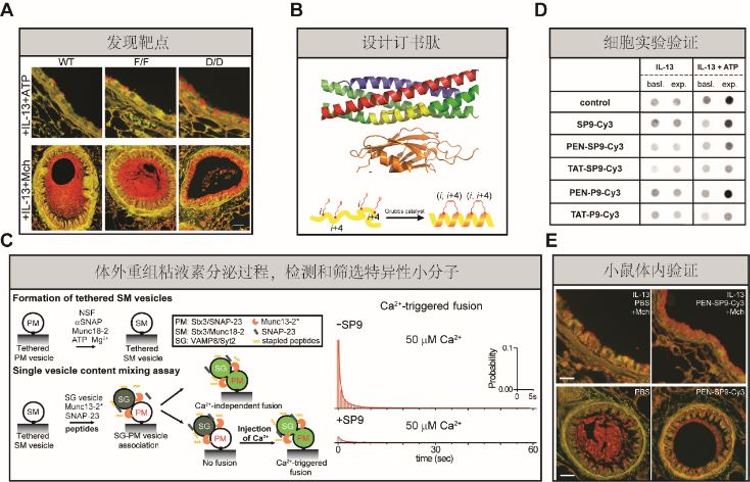
图1:研究揭示粘液素分泌的调控机制,开发特异性多肽抑制剂,首次实现了在体内调节粘液素分泌过程。
综上所述,赖颖团队有机地整合和运用多学科交叉实验方法,阐明了气道SNARE、synaptotagmin、Munc13等蛋白在粘液素分泌过程中的分子机制,设计开发的特异性订书肽能够有效抑制粘液素过度分泌,成功缓解哮喘模型小鼠的气道阻塞症状,为针对囊泡融合过程的药物开发奠定了基础,具有重要的临床价值。此外,由于钙离子激发的SNARE蛋白介导的细胞分泌过程在分子调控机制上具有很高的保守性,该研究对其他细胞分泌相关疾病的治疗手段的开发具有重要的参考价值与指导意义。
① 凡本站注明“稿件来源:中国教育在线”的所有文字、图片和音视频稿件,版权均属本网所有,任何媒体、网站或个人未经本网协议授权不得转载、链接、转贴或以其他方式复制发表。已经本站协议授权的媒体、网站,在下载使用时必须注明“稿件来源:中国教育在线”,违者本站将依法追究责任。
② 本站注明稿件来源为其他媒体的文/图等稿件均为转载稿,本站转载出于非商业性的教育和科研之目的,并不意味着赞同其观点或证实其内容的真实性。如转载稿涉及版权等问题,请作者在两周内速来电或来函联系。






 中国教育在线
中国教育在线



