西湖大学周强实验室新冠肺炎研究再出成果
在首次成功解析了新型冠状病毒细胞表面受体ACE2的全长三维结构,以及新型冠状病毒表面S蛋白受体结合结构域与细胞表面受体ACE2全长蛋白复合物的三维结构后,西湖大学周强实验室在新冠研究方面再次取得了新成果。
西湖大学周强团队利用冷冻电镜解析了新冠病毒S蛋白与中和抗体4A8复合物的结构。该抗体是由陈薇院士团队从新冠康复病人的免疫细胞中筛选和鉴定,针对新冠病毒S蛋白的N端结构域,具有强病毒中和能力。
该工作为靶向S蛋白N端结构域的药物设计和治疗策略提供了基础。相关研究成果已于北京时间5月9日在预印版平台bioRxiv上线。
(A potent neutralizing human antibody reveals the N-terminal domain of the Spike protein of SARS-CoV-2 as a site of vulnerability
https://www.biorxiv.org/content/10.1101/2020.05.08.083964v1)

本次研究中,陈薇院士团队的研究人员从感染新型冠状病毒后康复病人的记忆B细胞和浆细胞中分离初筛抗体,获得了399种单克隆抗体。经过人体体外环境的抗原抗体亲和力检测,以及活病毒和假病毒(即无扩增能力,而保留了侵染能力的病毒)的中和实验后,发现抗体4A8具有强病毒中和能力,可以明显抑制病毒的活性。
随后,周强实验室利用冷冻电镜技术,解析了4A8抗体与新冠病毒S蛋白的高分辨率复合物结构,可以清楚的看到二者的相互作用界面。
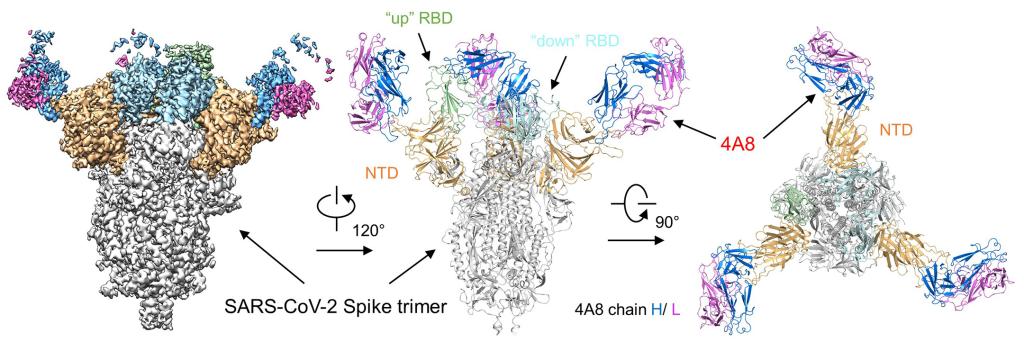
新冠病毒S蛋白与单克隆抗体4A8复合物的冷冻电镜密度图(左)及结构图
研究显示,4A8抗体通过重链与新冠病毒S蛋白的氮端结构域(NTD)相结合。在复合物的结构中,他们解析了NTD结构域的3个柔性片段(意为构象容易发生变化的区域),在之前解析的新冠病毒S蛋白的结构中,这部分序列因为其柔性而未被解析。之后的结构分析发现,中和抗体4A8的可变区与其中的两个柔性片段相互作用,因而稳定了该部分结构。
S蛋白以三聚体形式存在,含有三个单体。每个S蛋白单体中的NTD都能被4A8结合,且相互作用界面并无差别。抗体的结合在空间上不会影响S蛋白受体结合区域(RBD)的位置及RBD与细胞表面受体ACE2的结合。
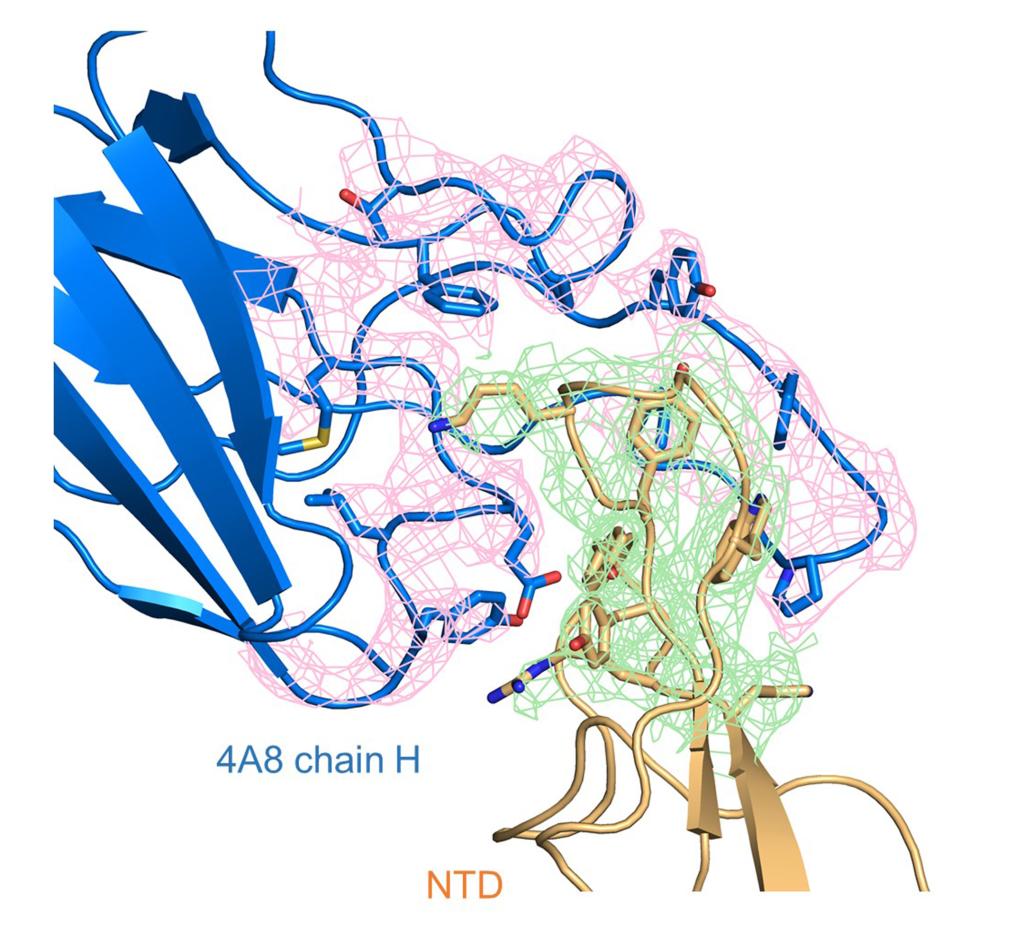
新冠病毒S蛋白的N端结构域(NTD)和4A8重链的相互作用界面密度示意图
此前,在针对新冠病毒的研究中,抗体设计、药物设计主要靶向新冠病毒S蛋白的RBD区域,鲜有针对S蛋白其它区域的靶向治疗策略。
看清4A8抗体与新冠病毒S蛋白的复合物结构,为靶向新冠病毒氮端结构域的药物设计和治疗策略提供了结构基础。同时,4A8作为一种抑制病毒侵染人体细胞能力较强的抗体,也可以和作用于新冠病毒S蛋白其他区域的抗体联合使用,从而提高新冠治疗的成功概率。
本次研究西湖大学生命科学学院博士后鄢仁鸿为共同第一作者。西湖大学生命科学学院特聘研究员周强为共同通讯作者。
免责声明:
① 凡本站注明“稿件来源:中国教育在线”的所有文字、图片和音视频稿件,版权均属本网所有,任何媒体、网站或个人未经本网协议授权不得转载、链接、转贴或以其他方式复制发表。已经本站协议授权的媒体、网站,在下载使用时必须注明“稿件来源:中国教育在线”,违者本站将依法追究责任。
② 本站注明稿件来源为其他媒体的文/图等稿件均为转载稿,本站转载出于非商业性的教育和科研之目的,并不意味着赞同其观点或证实其内容的真实性。如转载稿涉及版权等问题,请作者在两周内速来电或来函联系。






 中国教育在线
中国教育在线



