近日,南开大学药物化学生物学国家重点实验室帅领课题组利用小鼠单倍体胚胎干细胞筛选系统在细胞氧化应激及胚胎干细胞命运决定机制等领域揭示了多项重要发现,相关研究成果先后发表于国际知名学术期刊Cell reports及Cell Death & Disease。
近年来,南开大学药物化学生物国家重点实验室帅领研究员课题组已经成功建立了小鼠单倍体胚胎干细胞系。相比传统的胚胎干细胞,其具有纯合子的特色,即能够从基因型直接显示表型,因此是探索隐性遗传基因功能的绝佳工具细胞。
目前,帅领课题组已建立了多种类型的单倍体干细胞系并筛选了河豚毒素类似物的靶点基因以及多种重要生物学现象,如:重编程、滋养层细胞特化、多能性退出等的关键限制基因,凸显了单倍体系统在遗传学筛选上的巨大作用。
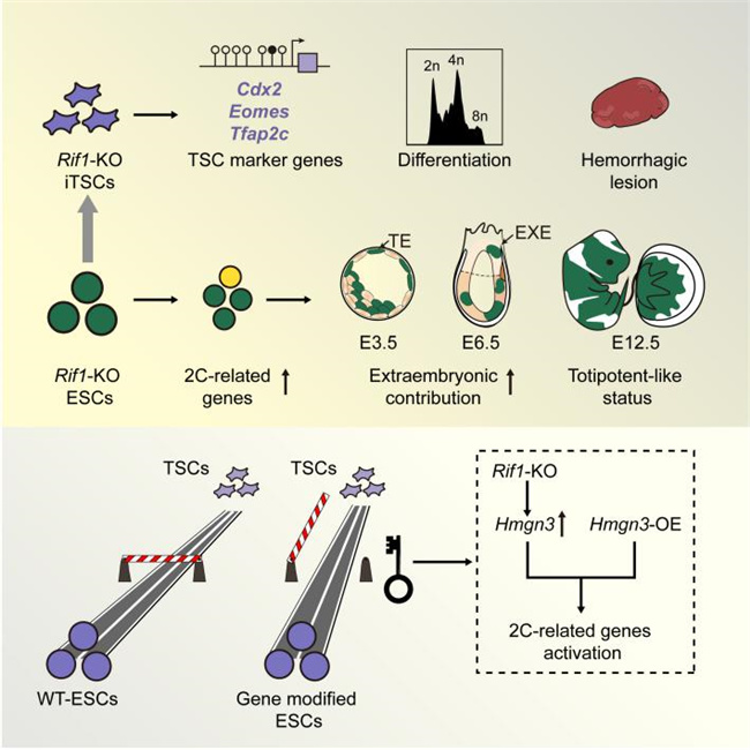
3月29日,帅领课题组联合天津医科大学吴旭东课题组在Cell子刊Cell Reports在线发表了关于小鼠胚胎发育的首次细胞命运决定机制的相关研究。该研究发现,端粒相关蛋白rap1相互作用因子1(RIF1)在小鼠胚胎干细胞(ESCs)向滋养层干细胞(TSCs)转变的关键作用,揭示了内细胞团(ICM)和滋养层细胞(TE)之间相互转变的关键屏障。
论文第一作者、南开大学药物化学生物学国家重点实验室张文豪博士介绍,小鼠胚胎第一次细胞命运决定使得卵裂球逐渐分化形成两种不同的细胞类型,即ICM和TE。ICM会进一步发育为胎儿,而TE进一步发育为胎盘。在自然情况下,二者之间很难相互转变,因此探究ICM与TE谱系间细胞命运转变的关键调控基因对于了解细胞命运决定机制以及全能性向多能性发展的具体过程具有重要指导意义。
Rif1及Hmgn3调控小鼠ESCs转变为TSCs的模式图
帅领课题组发现Rif1的缺失可以促进小鼠ESCs在细胞和分子水平上转化为诱导的TSCs(iTSCs),同时Rif1-KO可激活一些2-细胞胚胎阶段特异性的基因,进而诱发类全能性状态。为进一步解释RIF1的功能,通过设计嵌合实验、荧光报告系统等实验,发现了转变过程中Rif1的下调启动了另一个重要的调控因子—编码核小体结合蛋白家族成员Hmgn3,该基因的过表达也能够促进ESCs往TSCs的转变,从而揭示ICM和TE之间相互转变的关键屏障。这一发现为进一步探究早期胚胎发育过程中的细胞命运决定提供了新的思路。
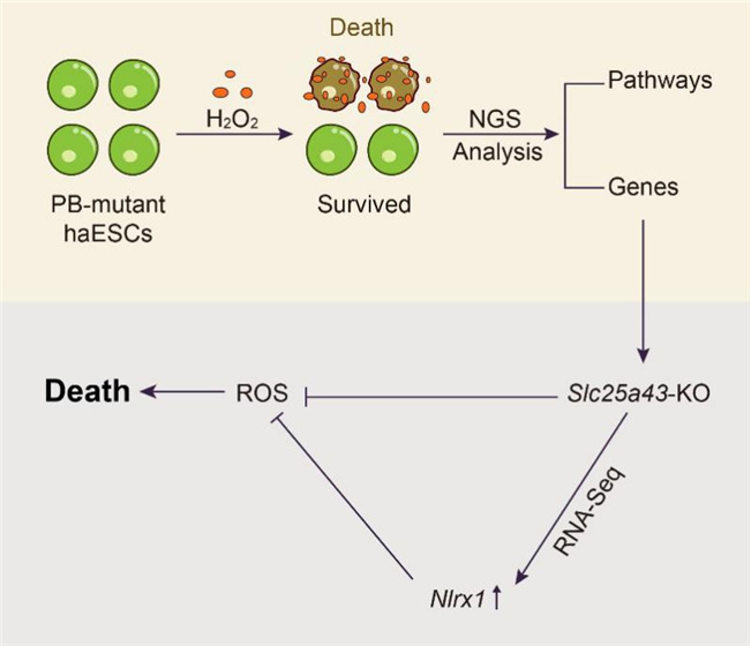
3月30日,Nature子刊Cell Death & Disease在线发表了帅领课题组关于细胞氧化应激的另一项研究成果。该工作同样通过小鼠单倍体筛选系统,发现敲除Slc25a43可以增强细胞对H2O2诱发的氧化损伤的抗性,推动了氧化应激机制的深入研究。
氧化应激靶点基因Slc25a43及其调控示意图
论文第一作者、南开大学药学院博士生张金鑫介绍,课题组利用piggyBac转座子系统对小鼠单倍体胚胎干细胞进行全基因组突变,并使用强氧化剂H2O2进行处理,筛选并获得了具有氧化应激抗性的靶点基因库,其中Slc25a43敲除细胞表现出了强大的抗氧化能力。为进一步揭示Slc25a43敲除的抗氧化能力,研究人员利用化学抑制剂及转录组分析等方式阐明了Slc25a43敲除会通过调控GPX4和Nlrx1增强细胞的抗氧化能力增强细胞的抗氧化能力。
帅领介绍,氧自由基(ROS)是机体代谢的产物,目前已有研究表明ROS能够调控干细胞的体外分化及体细胞重编程过程,因此寻找ROS的靶点基因和调控机制对临床疾病的研究和再生医学都具有十分重要的意义。
“我们的研究揭示了Slc25a43是ROS介导的氧化毒性的重要靶基因,并阐明了细胞内的抗氧化机制,为氧化应激损伤等疾病提供了良好的药物靶点及治疗策略。”帅领表示,该工作同时也为氧化应激相关疾病的研究奠定了理论基础。
① 凡本站注明“稿件来源:教育在线”的所有文字、图片和音视频稿件,版权均属本网所有,任何媒体、网站或个人未经本网协议授权不得转载、链接、转贴或以其他方式复制发表。已经本站协议授权的媒体、网站,在下载使用时必须注明“稿件来源:教育在线”,违者本站将依法追究责任。
② 本站注明稿件来源为其他媒体的文/图等稿件均为转载稿,本站转载出于非商业性的教育和科研之目的,并不意味着赞同其观点或证实其内容的真实性。如转载稿涉及版权等问题,请作者在两周内速来电或来函联系。






 教育在线
教育在线




