近日,西安交大物理学院张磊教授团队与四川大学、山东大学、国家蛋白质中心(上海)、香港中文大学等单位合作,采用冷冻电镜技术在多巴胺受体调节机制方面取得重大进展。
作为一种能够给人带来愉悦感受的神经递质,多巴胺(Dopamine)在中枢神经系统疾病治疗中具有重要作用,可调节如成瘾、记忆、奖赏、新陈代谢和激素分泌等多种生理过程。目前已知多巴胺受体包含D1和D2类两个亚家族,其中D1类受体(DRD1和DRD5)通过激活Gs/Golf和刺激环磷酸腺苷(cAMP)的产生,调节中枢神经系统奖赏、运动和认知,并在外周组织中抑制炎症反应和维持心血管与肾脏动态平衡等方面发挥有益作用;D2类受体(包括DRD2、DRD3和DRD4)与Gi/Go偶联,抑制cAMP积累并调节不同的生理效应。
以上5种多巴胺受体亚型具有很高的序列同源性并识别相同的内源性配体,虽然当前针对这5种亚型的药物开发已取得重要进展,但多巴胺受体亚型之间对激动剂识别、配体选择性、受体激活和G蛋白选择性的机制仍有待厘清。目前为止,D2类受体识别拮抗剂配体的分子机制和选择性激动剂Bromocriptine激活DRD2-Gi信号转导复合物的分子机制相继被揭示。然而D1类亚家族识别配体的结构基础仍然缺乏,无法为选择性激动剂的开发提供理论依据,从而无法满足高选择性激动剂等药物治疗帕金森病以及肾损伤高血压的临床需求。
采用冷冻电镜技术,联合团队首次解析了DRD1-Gs复合体分别结合儿茶酚类(Catechol like)激动剂(降血压药Fenoldopam、完全激动剂A77636和G蛋白偏向性激动剂SKF83959)、非儿茶酚类(Non-catechol like)激动剂PW0464,以及同时结合多巴胺和正向别构调节剂LY3154207的近原子分辨率三维结构。
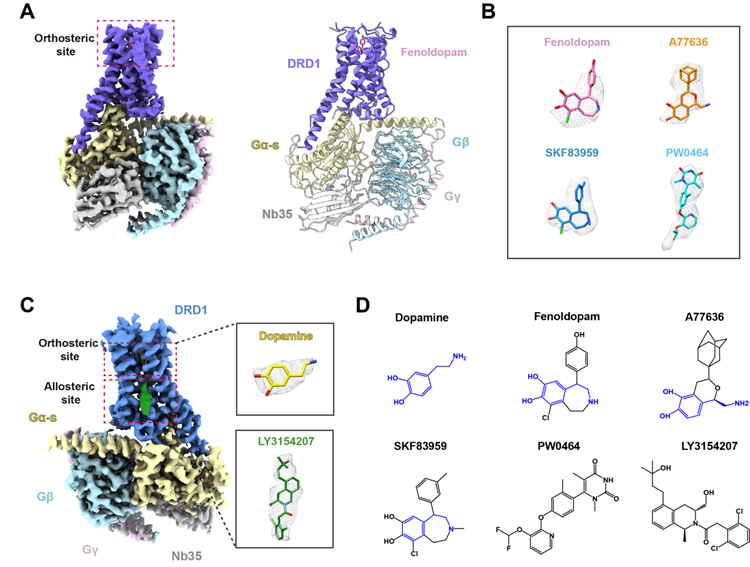
该研究对多巴胺受体的配体识别、激活机理以及信号转导选择等都具有广泛的影响。其主要发现包括:揭示了DRD1的正位结合口袋(orthosteric binding pocket,OBP)识别内源性荷尔蒙多巴胺及儿茶酚类激动剂配体的机制;阐明了DRD1非儿茶酚类激动剂的结合模式;揭示了DRD1延伸结合口袋(extended binding pocket,EBP)的结构功能特征;发现了DRD1的正向别构调节(positive allosteric modulator,PAM)位点;提出了DRD1对G蛋白偶联和选择性的关键残基。
综上所述,联合团队利用单颗粒冷冻电镜技术解析了多巴胺受体DRD1与G蛋白的复合物结构,从而在原子层面上详细阐释了DRD1的配体识别、别构调节及与G蛋白偶联的机制,该项研究将为高血压、帕金森综合症、肾损伤等疾病的药物开发和治疗带来新的曙光。
① 凡本站注明“稿件来源:教育在线”的所有文字、图片和音视频稿件,版权均属本网所有,任何媒体、网站或个人未经本网协议授权不得转载、链接、转贴或以其他方式复制发表。已经本站协议授权的媒体、网站,在下载使用时必须注明“稿件来源:教育在线”,违者本站将依法追究责任。
② 本站注明稿件来源为其他媒体的文/图等稿件均为转载稿,本站转载出于非商业性的教育和科研之目的,并不意味着赞同其观点或证实其内容的真实性。如转载稿涉及版权等问题,请作者在两周内速来电或来函联系。






 教育在线
教育在线




