近日,上海交通大学生命科学技术学院、微生物代谢国家重点实验室吴更教授与武汉大学王连荣、陈实教授团队合作,揭示了细菌DNA硫化修饰中催化第一步反应的半胱氨酸脱硫酶发生构象变化,使其活性位点半胱氨酸朝向底物半胱氨酸移动5.5埃以发起攻击的催化机制。最新研究成果以“Structural Analysis of an L-Cysteine Desulfurase from an Ssp DNA Phosphorothioation System”为题发表在《mBio》杂志上。刘立琼等为第一作者,吴更、王连荣为通讯作者,上海交通大学生命科学技术学院、微生物代谢国家重点实验室为第一单位。本文是团队自2018年Nature Communications上发表的细菌采用SBD结构域识别硫化修饰DNA的结构机理及2020年Nature Microbiology上发表的II型DNA硫化修饰系统的SspB、SspE晶体结构的延续和扩展。
在细菌的DNA硫化修饰(不管是早先发现的Dnd修饰系统还是新近发现的Ssp修饰系统)途径中,都由一个半胱氨酸脱硫酶催化第一步的反应,即半胱氨酸脱硫酶的活性位点半胱氨酸对底物半胱氨酸上的硫原子发起亲核攻击反应,将活化的硫原子转移到半胱氨酸脱硫酶的活性位点半胱氨酸上,以进行后续的将硫原子加进DNA的反应。2020年4月初团队在Nature Microbiology上发表的文章“SspABCD-SspE is a phosphorothioation-sensing bacterial defense system with broad antiphage activities”,从探索海洋弧菌的高频单链磷硫酰化修饰入手,通过比较基因组学和分子遗传学手段,鉴定出以SspABCD为修饰元、SspE为限制元的单链磷硫酰化限制-修饰系统。该系统与之前发现的磷硫酰化(以DndABCDE为修饰元以产生双链DNA磷硫酰化、DndFGH为限制元)的Dnd系统均迥然不同,并首次阐明了细菌磷硫酰化限制-修饰系统赋予宿主抑制噬菌体入侵的能力。同时,通过结构生物学和生物化学手段,解析了SspB蛋白的晶体结构,揭示其两个保守motif的关键残基对其DNA缺刻酶活性非常重要;解析了SspE蛋白的晶体结构,发现其N端结构域有依赖于DNA磷硫酰化修饰的NTP水解酶活性,而其C端结构域有DNA缺刻酶活性,从而阐明了该系统DNA磷硫酰化修饰与限制两部分功能耦合的分子机理。研究还发现SspABCD作为修饰蛋白在宿主基因组DNA上产生磷硫酰化修饰,SspE作为限制元能够感应基因组DNA上的磷硫酰化修饰从而区别宿主自身与外源的遗传物质,并利用其核酸酶活性对入侵噬菌体的DNA进行大范围的缺刻,从而抑制噬菌体DNA的复制。
本研究解析了新发现的II型DNA硫化修饰系统中的半胱氨酸脱硫酶SspA(来源于弧菌)与底物半胱氨酸的复合物晶体结构,分辨率为1.8埃。结构揭示SspA通过其天冬酰胺N150和精氨酸R340残基来识别底物半胱氨酸,如果将这两个残基突变则会严重破坏细菌的DNA硫化修饰。在结构中,SspA的活性位点半胱氨酸C314与底物半胱氨酸的距离长达8.9埃,这就产生了一个有趣的问题——SspA是怎么催化脱硫反应的?通过计算机分子动力学模拟,作者发现SspA的活性位点半胱氨酸C314在催化过程中向底物半胱氨酸移动了5.5埃,从而把它们之间的距离缩短到便于发生反应的范围内。本研究通过简正模式分析,发现弧菌的SspA、大肠杆菌的IscS、链霉菌的DndA(这两个都是I型DNA硫化修饰系统的)的活性位点半胱氨酸虽然处在不同的相对位置和不同的二级结构上,但都有着向各自的底物半胱氨酸的运动。
本研究进一步通过在上海光源BL19U2生物小角X射线散射(简称SAXS)线站收集的数据,从头搭建了SspA在溶液中结构的分子模型。发现SspA在溶液中的结构与分子动力学模拟后SspA的结构更为接近,它们之间的SAXS数据的χ2偏差只有1.04埃,远低于从SspA的晶体结构推算出的SAXS数据之间的χ2偏差3.70埃。这从实验上证实了前述的计算机分子动力学模拟和简正模式分析的结果。
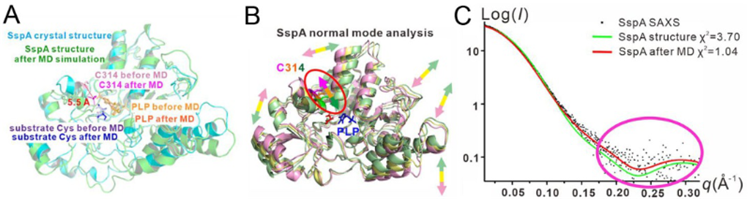

弧菌SspA的活性位点半胱氨酸在催化过程中,活性位点半胱氨酸朝向底物半胱氨酸移动了5.5埃的距离
(A)分子动力学模拟 (B)简正模式分析
(C)小角X射线散射实验数据与晶体结构经过分子动力学模拟后的结果和晶体结构的比较
本研究通过X射线晶体结构解析、分子动力学模拟、小角X射线散射等多种研究手段的结合,揭示了细菌DNA硫化修饰这一神奇现象中催化关键的第一步半胱氨酸底物脱硫反应的酶的催化机理,解答了半胱氨酸脱硫酶家族是如何克服活性位点半胱氨酸与底物半胱氨酸之间很长的距离这一长期悬而未决的问题,使人们对于细菌DNA硫化修饰的认识和理解又前进了一步。该研究获国家自然科学基金(31872627、31670106)的支持。
① 凡本站注明“稿件来源:中国教育在线”的所有文字、图片和音视频稿件,版权均属本网所有,任何媒体、网站或个人未经本网协议授权不得转载、链接、转贴或以其他方式复制发表。已经本站协议授权的媒体、网站,在下载使用时必须注明“稿件来源:中国教育在线”,违者本站将依法追究责任。
② 本站注明稿件来源为其他媒体的文/图等稿件均为转载稿,本站转载出于非商业性的教育和科研之目的,并不意味着赞同其观点或证实其内容的真实性。如转载稿涉及版权等问题,请作者在两周内速来电或来函联系。






 中国教育在线
中国教育在线



